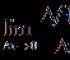Признаки и условия протекания химических реакций. Тепловой эффект химической реакции
1. Химические реакции. Признаки и условия их протекания. Химические уравнения. Закон сохранения массы веществ. Типы химических реакций.
2. Какой объем газа можно получить при взаимодействии 60г, 12% раствора карбоната калия с серной кислотой.
Химическая реакция
- превращение одного или нескольких веществ в другое.
Типы химических реакций:
1)Реакция соединения
– это реакции в результате которых из двух веществ образуется одно более сложное.
2)Реакция разложения
- это реакция в результате которых из одного сложного вещества образуется несколько более простых.
3)Реакция замещения
– это реакции между простым и сложным веществами, в результате которых образуется новое простое и новое сложное вещество.
4)Реакция обмена
– это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Условия протекания реакции:
1)Тесное соприкосновение веществ.
2)Нагревание
3)Измельчённость (быстрее всего идут реакции в растворах)
Любая химическая реакция может быть изображена с помощью химического уравнения.
Химическое уравнение – это условная запись химической реакции с помощью химических формул и коэфицентов.
В основе химических уравнений лежит закон сохранения массы вещества
: массы веществ вступивших в реакцию равна массе веществ получившихся в результате реакции.
Признаки химических реакций:
· Изменение окраски
· Выделение газа
· Выпадение осадка
· Выделение тепла и света
· Выделение запаха
2.

Билет №7
1. Основные положения Т.Э.Д. – теория электрической диссоциации.
2. Сколько грамм магния, содержащего 8% примесей, может прореагировать с 40г соляной кислоты.
Вещества, растворимые в воде могут диссоциировать, т.е. распадаться на противоположно заряженные ионы.
Электрическая диссоциация
–
распад электролита на ионы при растворении или расплавлении.
Электролиты
–
вещества, растворы или расплавы которых проводят электрический ток (кислоты, соли, щелочи).
Они образованы ионной связью (соли, щелочи), или ковалентной,сильнополярной (кислоты).
Не электролиты
–
вещества, растворы которых не проводят электрический ток (раствор сахара, спирта, глюкозы)
При диссоциации электролиты распадаются на катионы(+)
ианионы(-)
Ионы –
заряженные частица, в которые превращаются атомы, в результате отдатия и взятия ē
Химические свойства растворов электролитов определяются свойствами тех ионов, которые образуются при диссоциации.

Кислота
– электролит, который диссоциирует на катионы водорода и анион кислотного остатка.
Серная кислота диссоциирует на 2 катиона Н с зарядом (+) и
анион SO 4 с зарядои (-)
Основания
– электролит, который диссоциирует на катионы металла и гидроксид анионы.
Соли – электролит, который в водном растворе диссоциирует на катионы металла и анионы кислотного остатка.
2.
1. Реакции ионного обмена.
Скорость химической реакции – это изменение количества реагирующего вещества или продукта реакции за единицу времени в единице объема (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции).
Закон действующих масс : зависимость скорости реакции от концентрации реагирующих веществ. Чем выше концентрация, тем большее число молекул содержится в объеме. Следовательно, возрастает число соударений, что приводит к увеличению скорости процесса.
Кинетическое уравнение – зависимость скорости реакции от концентрации.
Твердые тела равны 0
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Общий порядок реакции - это сумма показателей степеней концентрации в кинетическом уравнении.
Константа скорости реакции - коэффициент пропорциональности в кинетическом уравнении.
Правило Вант-Гоффа: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два - четыре раза
Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
Молекулы должны обладать необходимой энергией (энергией активации).
Молекулы должны быть правильно ориентированы относительно друг друга.
Энергия активации - минимальное количество энергии, которое требуется сообщить системе, чтобы произошла реакция.
Уравнение Аррениуса устанавливает зависимость константы скорости химической реакции от температуры
![]()
A - характеризует частоту столкновений реагирующих молекул
R - универсальная газовая постоянная.
Влияние катализаторов на скорость реакции.
Катализатор – это вещество, изменяющее скорость химической реакции, но само в реакции не расходуется и в конечные продукты не входит.
При этом изменение скорости реакции происходит за счет изменения энергии активации, причем катализатор с реагентами образует активированный комплекс.
Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами).
Гетерогенный катализ - реагент и катализатор находятся в разных фазах - газообразной и твердой.
Гомогенный катализе - реагенты (реактивы) и катализатор находятся в одной фазе - например, оба являются газами или оба растворены в каком-либо растворителе.
Условия химического равновесия
состояние химического равновесия сохраняется до тех пор, пока остаются неизменными условия реакции: концентрация, температура и давление.
Принцип Ле-Шателье: если на систему, находящуюся в равновесии оказано какое-либо внешнее воздействии, то равновесии сместится в сторону той реакции, которое это действие будет ослаблять.
Константа равновесия – это мера полноты протекания реакции, чем больше величина константы равновесия, тем выше степень превращение исходных веществ в продукты реакции.
|
К р =С пр \С исх |
ΔG<0 К р >1 С пр > С исх
ΔG>0 К р <1 С пр <С исх
На протяжении всей жизни мы постоянно сталкиваемся с физическими и химическими явлениями. Природные физические явления для нас столь привычны, что мы уже давно не придаём им особого значения. Химические реакции постоянно протекают в нашем организме. Энергия, которая выделяется при химических реакциях, постоянно используется в быту, на производстве, при запуске космических кораблей. Многие материалы, из которых изготовлены окружающие нас вещи, не взяты в природе в готовом виде, а изготовлены с помощью химических реакций. В быту для нас не имеет особого смысла разбираться в том, что же произошло. Но при изучении физики и химии на достаточном уровне без этих знаний не обойтись. Как отличить физические явления от химических? Существуют ли какие-либо признаки, которые могут помочь это сделать?
При химических реакциях из одних веществ образуются новые, отличные от исходных. По исчезновению признаков первых и появлению признаков вторых, а также по выделению или поглощению энергии мы заключаем, что произошла химическая реакция.
Если прокалить медную пластинку, на её поверхности появляется чёрный налёт; при продувании углекислого газа через известковую воду выпадает белый осадок; когда горит древесина, появляются капли воды на холодных стенках сосуда, при горении магния получается порошок белого цвета.
Выходит, что признаками химической реакций являются изменение окраски, запаха, образование осадка, появление газа.
При рассмотрении химических реакций, необходимо обращать внимание не только на то, как они протекают, но и на условия, которые должны выполняться для начала и течения реакции.
Итак, какие же условия должны быть выполнены для того, чтобы началась химическая реакция?
Для этого прежде всего необходимы реагирующие вещества привести к соприкосновению (соединить, смешать их). Чем более измельчены вещества, чем больше поверхность их соприкосновения, тем быстрее и активнее протекает реакция между ними. Например, кусковой сахар трудно поджечь, но измельчённый и распылённый в воздухе он сгорает за считанные доли секунды, образуя своеобразный взрыв.
С помощью растворения мы можем раздробить вещество на мельчайшие частицы. Иногда предварительное растворение исходных веществ облегчает проведение химической реакции между веществами.
В некоторых случаях соприкосновение веществ, например, железа с влажным воздухом, достаточно, чтобы произошла реакция. Но чаще одного соприкосновения веществ для этого недостаточно: необходимо выполнение ещё каких-либо условий.
 Так, медь не вступает в реакцию с кислородом воздуха при невысокой температуре около 20˚-25˚С. Чтобы вызвать реакцию соединения меди с кислородом, необходимо прибегнуть к нагреванию.
Так, медь не вступает в реакцию с кислородом воздуха при невысокой температуре около 20˚-25˚С. Чтобы вызвать реакцию соединения меди с кислородом, необходимо прибегнуть к нагреванию.
На возникновение химических реакций нагревание влияет по – разному. Для одних реакций требуется непрерывное нагревание. Прекращается нагревание – прекращается и химическая реакция. Например, для разложения сахара необходимо постоянное нагревание.
В других случаях нагревание требуется лишь для возникновения реакции, оно даёт толчок, а далее реакция протекает без нагревания. Например, такое нагревание мы наблюдаем при горении магния, древесины и других горючих веществ.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
В главе 5.2 мы познакомились с основными принципами протекания химических реакций. Они и составляют теорию элементарных взаимодействий.
§ 5.3.1 Теория элементарных взаимодействий
Перечисленные ниже основные положения ТЭВ отвечают на вопрос:
Что необходимо для протекания химических реакций?
 1.
Химическая реакция инициируется активными частицами реагентов, отличными от насыщенных молекул: радикалами, ионами, координационно ненасыщенными соединениями. Реакционная способность исходных веществ определяется наличием в их составе этих активных частиц.
1.
Химическая реакция инициируется активными частицами реагентов, отличными от насыщенных молекул: радикалами, ионами, координационно ненасыщенными соединениями. Реакционная способность исходных веществ определяется наличием в их составе этих активных частиц.
Химия выделяет три основных фактора, влияющих на химическую реакцию:
- температура;
- катализатор (если нужен);
- природа реагирующих веществ.
Из них важнейшим является последний. Именно природа вещества определяет его способность образовывать те или иные активные частицы. А стимулы лишь помогают осуществиться этому процессу.
2. Активные частицы находятся в термодинамическом равновесии с исходными насыщенными молекулами .
3. Активные частицы взаимодействуют с исходными молекулами по цепному механизму.
4. Взаимодействие между активной частицей и молекулой реагента происходит в три стадии: ассоциации, электронной изомеризации и диссоциации.
На первой стадии протекания химической реакции - стадии ассоциации активная частица присоединяется к насыщенной молекуле другого реагента с помощью химических связей, которые слабее, чем ковалентные. Ассоциат может быть образован с помощью ван-дер-ваальсовой, водородной, донорно-акцепторной и динамической связи.
На второй стадии протекания химической реакции - стадии электронной изомеризации происходит важнейший процесс - преобразование сильной ковалентной связи в исходной молекуле реагента в более слабую: водородную, донорно-акцепторную, динамическую, а то и ван-дер-ваальсовую.
5. Третья стадия взаимодействия между активной частицей и молекулой реагента - диссоциация изомеризованного ассоциата с образованием конечного продукта реакции - является лимитирующей и самой медленной стадией всего процесса.
Великая «хитрость» химической природы веществ
Именно эта стадия определяет общие энергетические затраты на весь трехстадийный процесс протекания химической реакции. И здесь заключена великая «хитрость» химической природы веществ. Самый энергозатратный процесс - разрыв ковалентной связи в реагенте - произошел легко и изящно, практически не заметно во времени по сравнению с третьей, лимитирующей стадией реакции. В нашем примере так легко и непринужденно связь в молекуле водорода с энергией 430 кДж/моль преобразовалась в ван-дер-ваальсовую с энергией в 20 кДж/моль. И все энергозатраты реакции свелись к разрыву этой слабой ван-дер-ваальсовой связи. Вот почему энергетические затраты, необходимые для разрыва ковалентной связи химическим путем, значительно меньше затрат на термическое разрушение этой связи.
Таким образом, теория элементарных взаимодействий наделяет строгим физическим смыслом понятие «энергия активации». Это энергия, необходимая для разрыва соответствующей химической связи в ассоциате, образование которого предшествует получению конечного продукта химической реакции.
Мы еще раз подчеркиваем единство химической природы вещества. Оно может вступить в реакцию лишь в одном случае: при появлении активной частицы. А температура, катализатор и другие факторы, при всем их физическом различии, играют одинаковую роль: инициатора.
Разделы: Химия
Тип урока : приобретение новых знаний.
Вид урока : беседа с демонстрацией опытов.
Цели:
Обучающие - повторить отличия химических явлений от физических. Сформировать знания о признаках и условиях протекания химических реакций.
Развивающие - развивать умения, опираясь на знание химии, ставить несложные проблемы, формулировать гипотезы., обобщать.
Воспитательные – продолжить формирование научного мировоззрения учащихся, воспитывать культуру общения через работу в парах «ученик-ученик», «ученик-учитель», а также наблюдательность, внимание, пытливость, инициативу.
Методы и методические приемы : Беседа, демонстрация опытов; заполнение таблицы, химический диктант, самостоятельная работа с карточками.
Оборудование и реактивы . Лабораторный штатив с пробирками, железная ложечка для сжигания веществ, пробирка с газоотводной трубкой, спиртовка, спички, растворы хлорида железа FeCL 3 , роданида калия KNCS, медного купороса (сульфат меди) CuSO 4 , гидрооксида натрия NaOH, карбоната натрия Na 2 CO 3 , соляной кислоты HCL,порошок S.
Ход урока
Учитель. Мы изучаем главу «Изменения, происходящие с веществами» и знаем что изменения могут быть физическими и химическими. В чём отличие химического явления от физического?
Ученик. В результате химического явления изменяется состав вещества, а в результате физического явления состав вещества остается без изменения, а меняется лишь его агрегатное состояние или форма и размеры тел.
Учитель. В одном и том же опыте можно одновременно наблюдать химические и физические явления. Если медную проволоку расплющить молотком, то получится медная пластинка. Изменяется форма проволоки, но состав её остаётся прежним. Это физическое явление. Если медную пластинку нагреть на сильном огне, то исчезнет металлический блеск. Поверхность медной пластинки покроется чёрным налётом, который можно соскрести ножом. Значит, медь взаимодействует с воздухом и превращается в новое вещество. Это химическое явление. Между металлом и кислородом воздуха происходит химическая реакция.
Химический диктант
Вариант 1
Задание. Укажите о каких явлениях (физических или химических) идет речь. Поясните свой ответ.
1. Сгорание бензина в двигателе автомобиля.
2. Приготовление порошка из куска мела.
3. Гниение растительных остатков.
4. Скисание молока.
5. Выпадение дождя
Вариант 2
1. Горение угля.
2. Таяние снега.
3. Образование ржавчины.
4. Образование инея на деревьях.
5. Свечение вольфрамовой нити в лампочке.
Критерии оценивания
Максимально можно набрать 10 баллов (по 1 баллу за правильно указанное явление и по 1 баллу за обоснование ответа).
Учитель. Итак, вам известно, что все явления подразделяются на физические и химические. В отличие от физических явлений при химических явлениях, или химических реакциях, происходит превращение одних веществ в другие. Эти превращения сопровождаются внешними признаками. Для того чтобы познакомить вас с химическими реакциями, я проведу ряд демонстрационных опытов. Вам нужно определить признаки, по которым можно сказать, что произошла химическая реакция. Обратите внимание на то, какие условия необходимы для протекания этих химических реакций.
Демонстрационный опыт №1
Учитель. В первом опыте нужно выяснить, что происходит с хлоридом железа (111) при добавлении к нему раствора роданида калия KNCS.
FeCL 3 + KNCS = Fe(NCS) 3 +3 KCL
Ученик. Реакция сопровождается изменением окраски
Демонстрационный опыт №2
Учитель. В пробирку нальём 2 мл медного купороса, добавим немного раствора гидрооксида натрия.
CuSO 4 + 2 NaOH = Cu (OH) 2↓ +Na 2 SO 4
Ученик . Выпадает осадок голубого цвета Cu (OH) 2↓
Демонстрационный опыт №3
Учитель. К полученному раствору Cu (OH) 2↓ добавить раствор кислоты HCL
Cu (OH) 2↓ + 2 HCL = CuCL 2 +2 HOH
Ученик . Осадок растворяется.
Демонстрационный опыт №4
Учитель. В пробирку с раствором карбоната натрия прильём раствор соляной кислоты HCL.
Na 2 CO 3 +2 HCL = 2 NaCL + H 2 O + CO 2
Ученик . Выделяется газ.
Демонстрационный опыт №5
Учитель. Подожжем в железной ложечке немного серы. Образуется сернистый газ-оксид серы (4) - SO 2.
S + O 2 = SO 2
Ученик. Сера загорается синеватым пламенем, даёт обильный едкий дым, выделяется тепло и свет.
Демонстрационный опыт №6
Учитель. Реакция разложения пермангата калия - реакция получение и распознавания кислорода.
Ученик. Выделяется газ.
Учитель. Эта реакция идет при постоянном нагреве, стоит его прекратить, как прекращается и реакция (кончик газоотводной трубки прибора, где получали кислород, опущен в пробирку с водой - пока нагревание, кислород выделяется, и его можно заметить по выходящим из кончика трубки пузырькам, если же нагревание прекратить – прекращается и выделение пузырьков кислорода).
Демонстрационный опыт №7
Учитель. В пробирку с NH 4 CL хлоридом аммония добавить немного щелочи NaOH при нагревании. Попросить одного из учеников подойти и понюхать, выделяющийся аммиак. Предупредить ученика о резком запахе!
NH 4 CL +NaOH = NH 3 + HOH + NaCL
Ученик . Выделяется газ с резким запахом.
Учащиеся записывают в тетрадь признаки химических реакций.
Признаки химических реакций
Выделение (поглощение) тепла или света
Изменение цвета
Выделение газа
Выделение (растворение) осадка
Изменение запаха
Используя знания учащихся о химических реакциях, на основе проделанных демонстрационных опытов составляем таблицу условия возникновения и протекания химических реакций
Учитель. Вы изучили признаки химических реакций и условия их протекания. Индивидуальная работа по карточкам.
Какие из признаков характерны для химических реакций?
А) Образование осадка
Б) Изменение агрегатного состояния
В) Выделение газа
Г) Измельчение веществ
Заключительная часть
Учитель подводит итоги урока, анализируя полученные результаты. Выставляет оценки.
Домашнее задание
Приведите примеры химических явлений, которые встречаются в трудовой деятельности ваших родителей, в домашнем хозяйстве, в природе.
По учебнику О.С.Габриеляна «Химия -8 класс» § 26, упр. 3,6 с.96