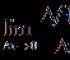Щелочность воды формула. Щелочность воды: что это такое, норма, расчет
Вода является основным жизненно важным элементом, без которого невозможно здоровое функционирование не только человеческого организма, но и всего живого на планете. Однако нередко случается так, что та вода, которая поступает в жилища людей или на промышленные предприятия, является настолько засоренной и непригодной для употребления и использования, что остро нуждается в проверке на несколько основных показателей и срочной очистке. Для того чтобы произвести правильную и эффективную очистку воды для бытового использования, сначала нужно понять из чего она состоит, выяснить определение щелочности воды ГОСТ и то, какие патогенные реакции и химические процессы загрязнение может вызвать при попадании в организм.
Для того чтобы понять важность своевременной проверки жидкостей на пригодность и определение щелочности воды, нужно также понимать, насколько важна и необходима жидкость для человеческого организма. Важность этого элемента и его необходимость человек может не замечать и принимать как данность. Однако от жидкости в теле человека зависит множество реакций и функций. Крепкое и здоровое тело – результат употребление здоровых продуктов питания и воды. Поэтому от чистоты и качества состава жидкости зависит напрямую длительность и качество жизни каждого человека. В воде, которую мы ежедневно употребляем в пищу или в чистом виде, может содержаться большое количество патогенных веществ и микроэлементов, бактерий и вирусов, которые при повышенной концентрации могут спровоцировать появление побочных заболеваний, инфекций, раковых опухолей и эпидемий.

Важно помнить, что отказаться от воды нельзя, поскольку человеческий организм состоит по большей части из жидкостей, запасы которых нужно постоянно пополнять. Поэтому избежать проблемы загрязнения и очистки воды невозможно. Международные организации постоянно работают над тем, чтобы придумать максимально эффективные и действенные способы как определить щелочность воды, проверить и очистить жидкости, дабы каждый человек мог быть уверенными в том, что употребляет максимально качественный фильтрованный продукт без наличия побочных примесей, бактерий и тяжелых металлов.
Для того чтобы понять, зачем нужно очищать и делать на щелочность, стоит сначала разобраться в том, какие основные свойства и критерии воды считаются жизненно важными для человеческого функционирования и здоровья. В настоящее время существует несколько стандартизирующих организаций, которые могут определить качество воды и нормы ее загрязненности:
- правила санитарного характера, которые устанавливает научное сообщество микробиологов и химиков Российской Федерации (ГОСТ щелочности воды, СанПиН РФ);
- стандарты качества воды и нормы ее очистки, которые регламентируются международными организациями по охране окружающей среди и здравоохранения (ВОЗ);
- нормы и рамки здорового очищения и состава воды, которые были оговорены научными сообществами и организациями стран Европейского Союза.
Что такое щелочность воды и для чего она нужна?
Щелочность питьевой воды в норме или, другими словами, кислотность воды, является специальным понятием, которое отображает наличие в воде активных ионов водорода, без которых невозможно осуществление многих химических и биологических реакций. Важно отметить, что впервые понятие щелочности воды единицы измерения было выведено и оформлено в единый показатель лишь в 1909 году датским ученым. Тогда для определения кислотности воды был введен символ pH. На что влияет щелочность воды? Примеси водорода в жидкости можно встретить практически везде, щелочь также присутствует в организме человека, что подтверждает важность данного химического понятия и его открытия. В начале двадцатого века было проведено много химических и микробиологических исследований, которые доказали наличие активной концентрации ионов водорода в человеческих тканях и жидкостях. Из этого следует, что от правильной нормы щелочности воды зависит напрямую слаженное и здоровое функционирование человеческого организма и всех его систем.Закажите бесплатно консультацию эколога
Щелочность питьевой воды является регламентированным и строго контролируемым показателем, рамки которого устанавливает и контролирует каждая страна. Прибор для определения кислотности и щелочности воды сигнализирует о том, что кислотность питьевой воды может отличаться от регламентированной кислотности воды для промышленных целей. В зависимости от типа производства и целей использования жидкости, многие предприятия имеют специальные буферы, в которых стабильно поддерживается постоянный уровень концентрации ионов водорода, необходимый для осуществления химических или биологических реакций.
Питьевая вода, согласно регламентированным международным рамкам, должна содержать водород в концентрации не более 9 единиц. Превышение этой нормы считается опасным для человеческого здоровья, поскольку из-за перенасыщения тканей тела водородом в жидкостях происходят необратимые химические реакции, которые влекут за собой биологические деформации и развитие патологий.
Как определить удовлетворительный уровень щелочности?
Поскольку из воды и жидких веществ состоит основная часть человеческих тканей и органов, употребление жидкого вещества является необходимым ритуалом, без которого невозможно прожить ни единого дня. По этой причине очень важно постоянно следить за составом и качеством воды, которая употребляется ежедневно. Малейшие сбои и отклонения от регламентированных рамок могут губительно сказаться на организме и его функционировании, спровоцировать появление многих опасных и даже неизлечимых недугов.Как определить щелочность воды в домашних условиях? Максимально пригодной и полезной для повседневного употребления человеком считается вода со щелочным показателем не выше 7,5-8,5. Такая норма называется слабой кислотностью и сигнализирует о нейтральном содержании активных ионов водорода, количество которых удовлетворяет все жизненно важные потребности и функции организма. Щелочность - как повысить щелочность воды? Очищается вода от лишней кислотности специальными фильтрующими установками или с помощью химических добавок. Если у человека нет возможности осуществлять регулярную очистку воды, использовать методику определения щелочности котловой воды и производить контроль ее качества, стоит приобретать уже очищенную воду в таре, которая продается в супермаркетах.

Правильная щелочность воды может повлиять на следующие факторы:
- Обменные процессы. Техника определения щелочности воды, видео которой мы привели выше, говорит о том, что стабилизация концентрации ионов водорода в воде приводит к тому, что в человеческом организме налаживаются обменные процессы и восстанавливается бактериальная флора желудочно-кишечного тракта.
- Умственная деятельность.Измеритель щелочности воды помог установить, что из-за нормированного поступления щелочности мозг человека работает слаженно, поскольку в него поступает достаточное количество кислорода и полезных веществ.
- Иммунитет. Благодаря поступлению в организм правильного количества щелочи стабилизируется иммунная система и налаживается работа эндокринной железы.
Щелочностью называется содержание в воде веществ, вступающих в реакцию с сильными кислотами. К этим веществам относятся:
– сильные основания;
– слабые основания: аммиак, анилин, пиридин и т.п.;
– анионы слабых кислот: , анионы гуминовых кислот.
Различают три формы щелочности: свободную, карбонатную и общую.
Свободная щелочность обусловлена гидроксильными и карбонатными ионами. Ее определяют количеством кислоты, идущей на титрование воды до pH 8,3.
Карбонатная щелочность зависит от наличия в воде только ионов угольной кислоты, т.е. карбонатных и гидрокарбонатных ионов, и определяется количеством кислоты, идущей на титрование воды до pH ≈ 4.
Общая щелочность обусловлена присутствием в воде анионов слабых кислот органического и неорганического происхождения, а также гидроксильных ионов.
В пресных незагрязненных водах карбонатная щелочность настолько велика по сравнению со щелочностью, вносимой другими анионами, что ее можно принимать равной общей щелочности.
Основным источником карбонатных и гидрокарбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, доломитов. Например,
СаСО 3 + Н 2 О + СО 2 ↔ Са 2+ + 2;
МgCO 3 + Н 2 О + СО 2 ↔ Mg 2+ + 2.
Некоторая часть гидрокарбонатных ионов появляется в результате метаморфизации продуктов химического выветривания изверженных пород:
CO 2 → + SiO 2 ;
OH – + CO 2 → .
Значительные количества гидрокарбонатных ионов поступают с атмосферными осадками и грунтовыми водами.
Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние, образуя малорастворимые соединения с ионами кальция, могут выпадать в осадок:
Са(НСО 3) 2 → СаСО 3 ↓ + Н 2 О + СО 2 ;
Са 2+ + = СаСО 3 ↓.
Этот процесс имеет очень важное значение в природе, поскольку от него зависит образование толщ карбонатных пород.
В поверхностных водах гидрокарбонатные и карбонатные ионы присутствуют главным образом в растворенном состоянии. Некоторая часть карбонатных ионов может находиться во взвешенном состоянии и близком к коллоидному состоянию в виде высокодисперсных частиц карбоната кальция.
В растворе между гидрокарбонатными и карбонатными ионами существует подвижное равновесие, определяемое константами диссоциации, характеризующими первую и вторую ступень диссоциации угольной кислоты
Н 2 СО 3 ↔ Н + + ↔ Н + + .
В речных водах содержание гидрокарбонатных ионов колеблется от 30 до 400 мг/дм 3 , в озерах – от 1 до 500 мг/дм 3 . Концентрация их в морских водах колеблется в более узких пределах от 100 до 200 мг/дм 3 , в атмосферных осадках она составляет 30 – 100 мг/дм 3 , в грунтовых водах − от 150 до 300 мг/дм 3 . В подземных водах их содержание заметно возрастает от 150 до 900 мг/дм 3 .
Щелочность является важной характеристикой поверхностных вод, по которой можно судить о важнейших гидрохимических и геохимических процессах, таких как формирование химического состава вод, эрозия земной поверхности, образование карбонатных пород и т.д.
В технике величина щелочности весьма существенна, поскольку от нее зависит коррозия бетона и выпадение карбонатной накипи в котлах, питающих различные паросиловые установки.
Для определения щелочности вод используют следующие методы: прямого титрования, обратного титрования и потенциометрические.
Методы прямого титрования основаны на титровании пробы воды сильной кислотой (НСl, H 2 SO 4) в присутствии различных индикаторов, имеющих переход окраски в точке эквивалентности в области рН от 3 до 4. К ним относятся метиловый оранжевый, бромфеноловый синий, метиловый желтый. Недостатком этого наиболее простого и быстрого метода являются неопределенность значения рН в конечной точке титрования. Для определения свободной щелочности обычно используют фенолфталеин, имеющий интервал перехода рН и окраски индикатора 8,2 – 10,0.
Более точны методы обратного титрования, которые основаны на прибавлении к пробе воды избытка сильной кислоты и его титриметрическом определении в присутствии индикатора. Эти методы находят наибольшее распространение, однако при анализе вод с низкой величиной щелочности (менее 10 мг/дм 3 ), а также окрашенных и мутных вод, возможны значительные погрешности, составляющие до 20 %.
В этих случаях предпочтительны различные варианты потенциометрических методов, в которых пробу исследуемой воды титруют сильной кислотой до определенного значения рН, определяемого с помощью рН-метра. На результаты не оказывают влияние следы активного хлора, мутность и окраска воды.
Щелочность воды определяются присутствием соединений, взаимодействующих с сильными кислотами. Это могут быть свободные гидроксиды (в производственных сточных водах) или соли, образованные слабыми кислотами и сильными основаниями (например, гидрокарбонаты, карбонаты, силикаты, сульфиды, ацетаты щелочных металлов). Щелочность, обусловленная наличием растворимых гидроксидов (ионами ОН -), называется гидратной щелочностью.
В природных водах щелочность обычно вызывается гидрокарбонатами НСО 3 - (гидрокарбонатная), в щелочных водах – также и карбонатами СО 3 2- (карбонатная).
Щелочность воды характеризуется количеством кислоты, необходимым для нейтрализации 1 л воды. Выражается она в мг-экв/л.
Различают свободную и общую щелочностью воды. Если рН исследуемой воды более 8,3, то считается, что вода имеет свободную щелочность. Ее величина определяется количеством кислоты, необходимым для нейтрализации компонентов щелочности (ОН - , SiO 3 -2 . CO 3 -2 и др.) до достижения величины рН исследуемой воды до 4,5 (или по изменению окраски метилоранжа). Если рН воды меньше 4,5, то щелочность воды принимается равной нулю. Считается, что воды, имеющие величину рН<8,3, не содержат свободной щелочности.
Определение щелочности воды проводится непосредственно после отбора пробы или не позднее 24 часов при условии хранения воды в закрытой посуде, заполненной под пробку.
Затруднения при проведении анализа и получение неточных результатов может быть вызвано наличием взвешенных веществ, свободной углекислоты, хлора и гипохлоритов, соединений, обуславливающих цветность воды. Мешающее влияние взвешенных веществ, устраняется фильтрованием воды. Гипохлориты и свободный хлор вызывают обесцвечивание кислотно-щелочных индикаторов, поэтому они предварительно восстанавливаются 0,1н раствором тиосульфата натрия, взятом в эквивалентном количестве. Иногда для удаления гипохлоритов используют 3%-ный раствор пероксида водорода. Цветность воды может быть снижена при фильтровании ее через слой активированного угля или макропористого анионита. Свободный углекислый газ удаляется путем продувания воздуха через анализируемую воду. Если в воде наряду с гидрокарбонатами в заметном количестве присутствуют гидросиликаты, силикаты, гидросульфиты, сульфиды или другие соединения, вызывающие щелочность воды, то для вычислений карбонатной (гидрокарбонатной) щелочности необходимо вычесть из полученного результата данные, полученные при определении этих компонентов (в мг-экв/л). Для вод с малой величиной щелочности для получения более точного результата (менее 0,2 мг-экв/л) необходимо использовать 0,05 н растворы кислот (соляной или серной).
Определение щелочности воды может проводиться объемным методом нейтрализации и электрометрическим (по величине рН).
В таблицах СанПиН РФ («Питьевая вода») предельно допустимая концентрация по щелочным показателям не указывается, поэтому большинство источников при определении нормы щёлочности воды ссылаются на стандарты ВОЗ, директиву ЕС или санитарные правила стран со сходным нормативным порядком.
Так, величина в 30 мг НСО3-/л устанавливается в ЕС-директиве при определении качества предназначенной для потребления человеком воды. В украинских актуальных правилах ГСанПиН для водопроводной воды параметр не устанавливается, а величина в < 6,5 ммоль/м 3 указывается только для фасованной и бюветной воды. Приведённые в российских тематических источниках значения чаще всего варьируются в пределах от 0,5 до тех же 6,5 ммоль/м 3 .
При этом существует ГОСТ 31957-2012 – Межгосударственный стандарт, подписанный органами по стандартизации 6 стран и модифицированный по отношению к другим международным стандартам. Россия, наряду с Арменией, Казахстаном, Киргизией, Таджикистаном, Узбекистаном, входит в число стран, подписавших документ, в котором описываются методы определения щёлочности в концентрации 0,1-100 ммоль/дм 3 .
Определение и содержание понятия
Щёлочностью воды («Щ» в формулах) называют сумму содержащихся в ней веществ – гидроксильных ионов/анионов слабых кислот, – вступающих с сильными кислотами в реакцию с разделением на:
- бикарбонатную (Щ б),
- карбонатную (Щ к),
- гидратную (Щ г),.
Единица измерения – миллиграмм-эквивалент кислоты, записывающийся как мг-экв/л. Общая щёлочность как сумма анионов слабых кислот – силикатов, боратов, карбонатов, гидрокарбонатов, сульфидов, гидросульфидов, сульфитов, гидросульфитов, фосфатов, анионов гуминовых кислот) – это способность связывать сильные кислоты (их эквивалентное количество). Концентрация некоторых ионов незначительна, поэтому, когда говорят об общей щёлочности, то имеют в виду, главным образом, карбонатный тип (определяющийся ионами угольной кислоты), где гидролизованные анионы образуют гидроксид-ионы:

Щелочной показатель для поверхностных вод связывают с присутствием в них в основном гидрокарбонатов щелочноземельных металлов (и щелочных – в меньшей степени), и для природных вод с pH < 8,3 он определяется концентрацией гидрокарбонатов магния и кальция. При определённой обработке водоресурса и при pH >8,5 происходит возникновение гидратного типа.
Щелочной параметр необходим для:
- определения содержания карбонатов, а также баланса угольной кислоты (вместе с рН),
- дозирования химических веществ, применяемых в водоснабжении,
- реагентной очистке,
- установлении пригодности водоресурса для ирригации (при избытке щелочноземельных металлов).
Северные районы России с низкими щелочными показателями и pH для природной воды характеризуются повышенной коррозионной агрессивностью, от которой страдают трубопроводы и конструкции из черных металлов и бетона.

По мнению японских исследователей, в районах, где пьют более щелочную воду (выше показателя 6,5, но ниже 9) продолжительность жизни выше на 20-30%. В целом щелочные показатели должны быть достаточными для прохождения химической коагуляции, однако при этом они не должны быть слишком высокими, чтобы не провоцировать физиологические расстройства у водопотребителей. Минимальные щелочные значения составляют +/- 30 мг/л, а максимальные в пределах 450-500 мг/л.
Распространившееся среди обладателей различных модифицированных аэраторов мнение об их влиянии на щелочные свойства гидропотока не подтверждается. Эти аэраторы-экономители (http://water-save.com/ ) позволяют сократить водорасход, но не влияют на химические характеристики водоресурса.
Методы определения концентрации карбонатов
В межгосударственном стандарте описаны 2 титриметрических метода расчёта щёлочности воды:
- Свободная и общая щёлочность. Для питьевой – расфасованной (негазированной) и из источников питьевого водоснабжения, – природной, а также сточной вод путём титрования (постепенного смешивания) до значения pH 8,3, а также 4,5. Полученные значения применяются для расчётов концентрации карбонатов (в диапазоне 6-6000 мг/дм 3) и гидрокарбонатов (6,1-6100 мг/дм 3).
- Карбонатная щёлочность. Для воды питьевой, природной, технической на разных стадиях технологических процессов путём титрования до pH 5,4 ед.
Конечная точка титрования определяется при изменении значения на рН-метре или окраски индикатора:
- рН-переход от розового к бесцветному при 8,3-8,0 даёт величину параметра «по фенолфталеину»,
- рН-переход от оранжевого к жёлтому при 4,4 даёт величину параметра «по метиловому оранжевому».
Равным нулю параметр принимается, если для анализируемой пробы рН<4,5.
Щелочность воды – это общее содержание в воде веществ, обуславливающих при диссоциации или в результате гидролиза повышенную концентрацию ионов ОН - .
В исходной воде щелочность обычно связана с присутствием ионов . В умягченной и котловой воде, кроме перечисленных веществ, щелочность обусловливается также ионами В зависимости от того, какой анион присутствует в воде , щелочность называется соответственно бикарбонатной Щ б, карбонатной Щ к или гидратной Щ г.
Большая щелочность воды определяется количеством соляной кислоты, затраченной на титрование анализируемой пробы воды (100 мл пробы) в присутствии индикатора фенолфталеина (I этап) и метилоранжа (II этап) 0,1 н. Количество кислоты (мл), израсходованной при титровании, равно щелочности испытуемой воды при рН = 3...4 .
Малая щелочность воды определяется путем титрования 100 мл пробы в присутствии фенолфталеина (I этап) и метилрота или смешанного индикатора (II этап) 0,01 н. раствором серной или соляной кислоты. Величина щелочности при этом определяется по формуле:
где п – количество израсходованного 0,01 н. раствора кислоты, мл.
Анализы по определению отдельных форм щелочности основаны на том, что при титровании пробы воды сильной кислотой, реакции, протекающие между кислотой и различными анионами, обусловливающими форму щелочности, заканчиваются при различных значениях рН раствора. Титрование проводится в присутствии двух индикаторов, каждый из которых рассчитан на определенный диапазон значений рН. Одним индикатором является метилоранж, окраска которого изменяется на желтую в кислой среде при рН=3...4, вторым - фенолфталеин, окраска которого изменяется на розовую в щелочной среде при рН > 8,4. Следует особо отметить, что значение рН=8,4 имеют растворы чистых гидрокарбонатов (НСО3), постоянно присутствующих в водах. При анализе пробы воды на первом этапе используется фенолфталеин, а на втором - метилоранж.
Оценка отдельных форм щелочности производится в соответствии с полученными при титровании данными. При этом возможны следующие случаи:
1) фенолфталеин не дает розового окрашивания, т.е. Ф = 0, где Ф - расход соляной кислоты, пошедшей на титрование пробы, окрашенной фенолфталеином, мл. Метилоранж дает желтое окрашивание пробы, которая затем титруется соляной кислотой до изменения окраски. В этом случае в воде присутствуют только бикарбонаты (бикарбонатная щелочность) Щб, которая подсчитывается по формуле (1), где А = М, а М - расход кислоты на титрование пробы воды, окрашенной метилоранжем, мг-экв/л;
2) фенолфталеин дает розовое окрашивание, причем при титровании пробы оказалось, что 2Ф < М. В этом случае в воде присутствуют как бикарбонаты, так и карбонаты. Расчет Щб производится по формуле (1), где А = М - 2Ф, для расчета Щк следует принять А = 2Ф;
3) фенолфталеин дает розовое окрашивание, причем 2Ф = М. В этом случае в воде присутствуют только карбонаты; для расчета Щк в формулу (1) следует подставить А = 2Ф;
4) фенолфталеин дает розовое окрашивание, причем 2Ф>М. В этом случае в воде присутствуют карбонаты и гидраты. Для расчета Щк в формулу (1) следует подставить А=2(М-Ф), а для расчета Щг - А = (2Ф - М);
5) фенолфталеин дает розовое окрашивание, причем М = 0 (т.е. после обесцвечивания фенолфталеина дальнейшее увеличение объема метилоранжа сразу вызывает оранжевую окраску пробы воды). В этом случае присутствуют только гидраты; для расчета Щг в формулу (1) следует подставить А = Ф. При Кн = 0,1 мг-экв/л и V = 100 мл для определения формы и численного значения щелочности удобно пользоваться таблицей.